USP <1079> Modifiche che devi conoscere
Nella seconda parte di questa serie analizzeremo i cambiamenti che riguardano l’USP <1079> e come prepararci per i rischi e le strategie di mitigazione attraverso lo stoccaggio e il trasporto di prodotti farmaceutici finiti. La farmacopea degli Stati Uniti (USP) ha programmato modifiche nel 2020 ai capitoli chiave che potrebbero interessare le aziende farmaceutiche. È importante che tutte le aziende farmaceutiche siano consapevoli dei cambiamenti e pianifichino in che modo i cambiamenti influenzeranno la loro conservazione e distribuzione.
Quale capitolo sta cambiando?
L’USP ha programmato di rilasciare ad agosto 2020 le modifiche all’USP <1079> che saranno rese ufficiali a dicembre 2020. Le nuove modifiche all’USP <1079> sono significative e sottolineano la necessità per tutte le aziende che immagazzineranno, gestiranno o trasporteranno prodotti che richiedono etichette di temperatura, di soddisfare un sistema di gestione della qualità (QMS) completo. L’USP <1079> delinea buone pratiche di conservazione e distribuzione dei farmaci sensibili alla temperatura in tutte le fasi della catena del freddo. Il capitolo esistente si intitola “Buona conservazione e distribuzione dei prodotti farmaceutici“. Il nuovo titolo proposto per il capitolo sarà: “Rischi e strategie di mitigazione per lo stoccaggio e il trasporto di prodotti farmaceutici finiti“.
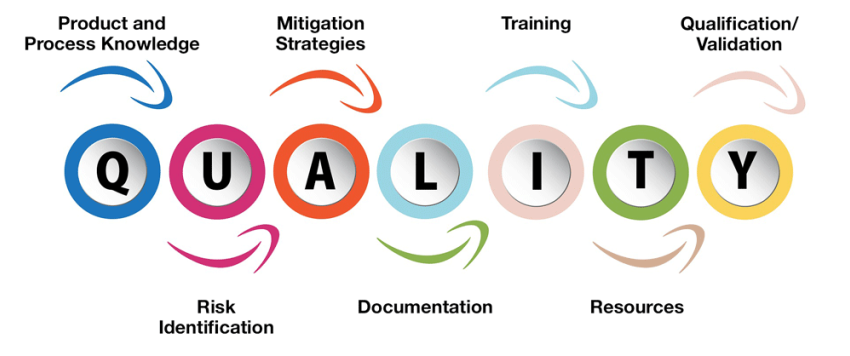
Il cambiamento è definito
Il nuovo capitolo USP <1079> si concentra sulla conoscenza del prodotto e del processo, l’identificazione del rischio, le strategie di mitigazione, la documentazione, la formazione, le risorse e la qualificazione / convalida, il tutto portando a un sistema di gestione della qualità (QMS) ben progettato. Uno dei cambiamenti significativi è un nuovo capitolo che delinea i ruoli delle organizzazioni all’interno della catena di approvvigionamento. Definisce in modo specifico le responsabilità di produttori, grossisti, distributori, farmacie, farmacie in via di sviluppo, ospedali, operatori sanitari, broker e fornitori di servizi logistici.
Il nuovo USP <1079> definisce i requisiti di tutti i partner all’interno della catena di fornitura, dal produttore alla farmacia dell’ultimo miglio, e le responsabilità che tutti devono seguire per proteggere il prodotto e garantire il successo del paziente. Le responsabilità riguardano qualificazione e validazione come mappatura della temperatura, qualificazione del pacchetto di spedizione, sistemi di monitoraggio e allarmi, validazione del software, calibrazione, gestione delle escursioni e addestramento.
La definizione della temperatura del prodotto che era nell’USP <1079> ora risiede nel capitolo USP <659>.
Vedi blog: Perché i requisiti dell’USP <659> per l’imballaggio e lo stoccaggio sono importanti?
Nuovo sottocapitolo USP <1079.2>
L’USP ha anche scritto un nuovo sotto-capitolo dell’USP <1079> chiamato USP <1079.2> “Temperatura cinetica media nella valutazione delle escursioni termiche durante lo stoccaggio e il trasporto di prodotti farmaceutici”. L’USP prevede di aggiungere nuovi sottocapitoli per integrare il nuovo USP <1079> e sono:
- USP <1079.1> Conservazione e trasporto di prodotti farmaceutici in fase di sperimentazione
- USP <1079.2> Temperatura cinetica media nella valutazione delle escursioni termiche durante lo stoccaggio e il trasporto di prodotti farmaceutici
- USP <1079.3> Dispositivi di monitoraggio: tempo, temperatura e umidità sostituiranno l’USP <1118>
- USP <1079.4> Qualificazione delle aree di stoccaggio
- USP <1079.5> Qualificazione dei sistemi di spedizione
- USP <1079.6> Qualifica della profilazione del percorso di trasporto
- USP <1079.7> Sistemi di informazione per studi di convalida / verifica della distribuzione
Per saperne di più sulla revisione dell’USP <1079> imballaggio e Requisiti di archiviazione e la prossima pubblicazione dell’USP <1079> .